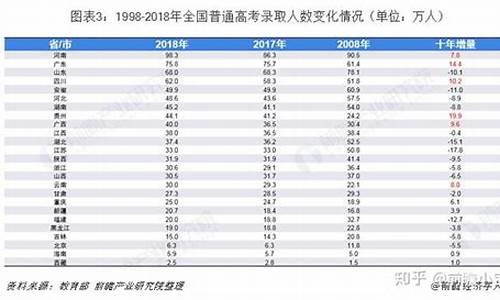
您现在的位置是: 首页 > 招生信息 招生信息
2014年江西高考理综_2014江西高考化学
tamoadmin 2024-05-20 人已围观
简介这一题根据基本原理“强酸制弱酸”,或者也可以理解为“电离能力大的制电离能力弱的”。根据已知的电离常数,我们可以得出这些离子的酸性强弱(电离能力强弱):H2SO3 > H2CO3 > HSO3- > HCO3-现在我们分析各选项:A:CO32-与HSO3-:这一组,HSO3-酸性比HCO3-强,所以会发生反应:HSO3- + CO32- = HCO3- + SO32-(由HSO3-

这一题根据基本原理“强酸制弱酸”,或者也可以理解为“电离能力大的制电离能力弱的”。
根据已知的电离常数,我们可以得出这些离子的酸性强弱(电离能力强弱):H2SO3 > H2CO3 > HSO3- > HCO3-
现在我们分析各选项:
A:CO32-与HSO3-:这一组,HSO3-酸性比HCO3-强,所以会发生反应:HSO3- + CO32- = HCO3- + SO32-(由HSO3-制HCO3-,可以理解是强酸制弱酸,也可以理解是电离能力强的制弱的),所以A这一组离子不可能大量共存的。
B:HCO3-与HSO3-,前者对应的酸是H2CO3,H2CO3酸性却强于HSO3-,所以HSO3-不会与HCO3-反应得到H2CO3 ;同理,因为HSO3-对应的酸是H2SO3,而HCO3-的酸性更是远远弱于H2SO3,所以更不可能由HCO3-与HSO3-反应得到H2SO3.所以这一组可以共存。
C:SO32-与HSO3-:这一组离子共存于平衡:HSO3- = SO32- + H+中,可以大量共存;
D:H2SO3与HSO3-这一组不能大量共存,因为溶液中除了平衡一:H2SO3 = H+ + HSO3-外,还存在另一平衡:H2SO3 = SO2 + H2O,当两者大量存在,溶液中会逸出SO2气体。这样理解更容易。
综上,能共存的是BC
生物:理科中较偏文科的一项,但还是有很多计算的项目。所以我建议你列表,把固定考的计算以及识计内容用导图的形式列出来,这样绝对清晰(还记得你当年学文科的时候 学政治是不是条路清晰呢?)
化学:很麻烦,特别麻烦(绝对不简单)所以我建议你买本王后熊的考点专题学案(有5本吧)。最后找你老师询问重点(估计你不喜欢问老师吧 但最后几十天了 不问后悔一辈子)化学老师一般都给你画个framework的(还不是框架的意思 就是差不多的意思)
但是,我说句实话,最后这三个月别人再怎么祝愿你 你再怎么努力,即使可以提升你也要理应的掂量某些事情了,我的意思是为了考试而学了,也不是你三个月提升上去不公平什么的。只是人提升需要磨砺与顿悟,这三个月你肯定最注意的是进度而不是……所以,希望你能保持好心态!(纯手打,看见你这个问题就戳进来了……O(∩_∩)O 若是帮到你一点就采纳啦)