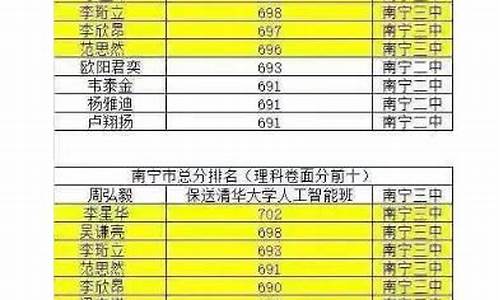
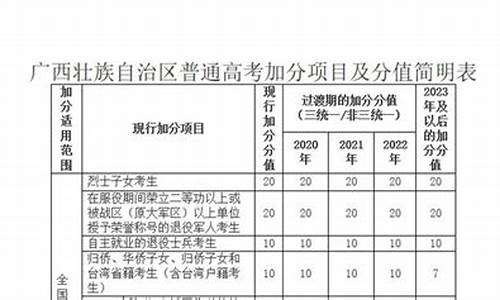
您现在的位置是: 首页 > 招生信息 招生信息
高考考点细目_高考考点清单
tamoadmin 2024-05-19 人已围观
简介1.2023新高考数学考点高考语文考点梳理 一、语言知识 (一)语音 1、难度有所降低,不故意为难考生。近几年的“对中选错”的命题思路,与以往的“错中选对”相比明显降低了难度。 2、注重异形同音汉字的误读和多音误读现象。 3、读音的字都是在声母或韵母上有所不同,不涉及声调问题。 4、词语、成语中难读字的读音要高度重视。例如“盥(guàn)洗”、“霰(xiàn)弹”、“饮鸩(zhèn)止渴”、“暴殄
1.2023新高考数学考点

高考语文考点梳理
一、语言知识
(一)语音
1、难度有所降低,不故意为难考生。近几年的“对中选错”的命题思路,与以往的“错中选对”相比明显降低了难度。
2、注重异形同音汉字的误读和多音误读现象。
3、读音的字都是在声母或韵母上有所不同,不涉及声调问题。
4、词语、成语中难读字的读音要高度重视。例如“盥(guàn)洗”、“霰(xiàn)弹”、“饮鸩(zhèn)止渴”、“暴殄(tiǎn)天物”、“卷帙(zhì)浩繁”。
(二)汉字
1、考查使用频率高且错误率高的词语。它们或音同、或音近、或形似、或义近而容易混淆。
2、词语与成语、熟语字形一并考查。
3、陈述句子中辨别错别字与词语组合式辨别错别字,交替命题。以后者的词语组合为重点,因为后者的考查面较前者大。
(三)正确使用标点符号。标点符号将纳入考试范围。
(四)词语
1、同义词、近义词、虚词的辨析仍然是词语考查的重点。
2、词语体现了鲜明的时代特征。均以当代使用率比较高的词语为主,内容涉及到当代政治、经济、文化、教育、军事、外交、哲学、体育诸多领域。
3、成语的考查仍然是一个重点。也是一个难点。纵观近十年考查的42个成语。其特点如下:
①感情色彩的误用。如“无所不为”、“处心积虑”、“趋之如鹜”。
②适用对象的误用。如“美轮美奂”、“炙手可热”、“洗心革面”。
③望文生义的错误。如“不刊之论”、“首当其冲”、“万人空巷”。
④容易混淆的成语。如“应接不暇”与“目不暇接”、“耸人听闻”与“骇人听闻”。
⑤具有双重含义的成语。如“苦心孤诣”、“灯红酒绿”。
4、考查的词语在常用与非常用之间。命题不太涉及生僻词语,但一些稍微生僻的词语也会考查,如“颐指气使”、“发祥地”。
(五)病句辨识
1、“搭配不当”题是每年高考试题中出现率最高的。搭配不当、句式杂糅、成分残缺、表意不明是经常出现的。
2、修改病句,也是经常出现的,常常放在Ⅱ卷中的语言运用题中。
3、病句题来源于当前的报章杂志。
4、辨析病句的方法。
二、古诗文阅读
(一)文言文阅读
1、涉及到的实词、虚词,越来越贴近教材。
2、文言文试题在变化中求发展。
①双文本的阅读测试,信息量因此而增大。
②语言题与内容理解、分析题比例由3:2发展为2:3。
③试题中“对作者在文中观点态度的分析、评价”设题明显。
3、文言句子的翻译
①句子翻译以直译为主。
②文言句式、关键词语是翻译的重点。
③文言句子的翻译侧重议论色彩的句子。
(二)背诵默写
1、课本名句。
2、一些课外常见的、常用的至今仍有一定生命力的能激励人向上的名句,这些名旬应有一定的思想性。文化内涵丰富且脍炙人口。
(三)古诗鉴赏
1、古诗鉴赏不讲全诗的宏观测试,而注重抓点带面。
2、往往借助古人的评点展开赏析。
3、采用一个开放性较强的主观性试题。
三、现代文阅读
1、社会科学类文章与自然科学类文章主要考查理解、判断、推断的能力。偏重于抽象思维的考查。
2、文学作品阅读,主要考查理解、分析、综合和鉴赏评价等方面的能力,偏重于形象思维的考查。
3、形象思维考查的内容及特点,散文考查的可能性最大,但小小说值得重视。
形象思维从设题方面要注意以下几点:
①较抽象语句的理解。
②形象的认识与把握。
③隐含义的挖掘。
4、科学类文章阅读在设置错误选项时,往往运用“似是而非”的手法。
①偷换概念。
②悖设因果。
③颠倒主次。
④扩大外延。
⑤改换性质。
在设置正确选项时,往往运用“似非而是”的手法。
5、文学作品阅读:
①对筛选并整合信息的能力的考查是重点,又是难点。
②继续加大改革力度,对一些主观性强的题目进一步突出开放性。
③加大现代散文阅读的难度。
四、语言的运用
(一)仿写、扩写、缩写
仿写:
1、每年命题的仿写句,大都在二至三句,形式多样。
2、仿写句大都围绕比喻、对偶、排比、反问等修辞格命题。
3、仿句侧重于正反意义的命题。
扩写:
1、扩展语句、重在围绕主题词展开。
2、扩展语句题与中学生活关系紧密。
缩写:
压缩语段题大都围绕“新闻”设题。
(二)简明、连贯、得体
简明的考查:对多余词语的删除。依据保留必备词语而不产生异义的标准。
连贯的3个条件:统一的话题、合理的句序、语言的衔接与呼应。连贯题常考常新。
得体大都侧重在人与人的称呼上,语境的场合上.情感的色彩上。
今后要注意的形式:
①将表格内容转换为文字表述。
②对对子。
五、作文
(一)高考作文的开放性原则
在内容上,高考作文的题材应该尽量开阔,触及的面应该尽量宽广。在形式上,将继续坚持“三自”方针.淡化文体要求。选材更加自由,给考生更大限度的写作自由。
(二)高考作文的限制性原则
话题作文是在一定限制的情况下让学生自由地发挥.从而检测学生在作文能力上所达到的高度。在写作要求方面限制性也较以往有所增强,有效地起到了抑制、减少乃至杜绝宿构、套写、抄袭的作用。
(三)培养发散思维,强调辩证意识
发散思维与求同思维是一对矛盾。近几年来,高考作文十分强调话题的发散性、多元性、辩证性、多角度、立体化。而今年全国高考作文题意味着辩证思维的作文开始回归
2023新高考数学考点
考点是我们复习化学的过程中最近注意的重要知识点。下面是我为您带来的,希望对大家有所帮助。
:
1:各种“水”汇集
一纯净物:
重水D2O;超重水T2O;蒸馏水H2O;双氧水H2O2;水银Hg;水晶SiO2。
二混合物:
氨水分子:NH3、H2O、NH3·H2O;离子:NH4 、OH?、H
氯水分子:Cl2、H2O、HClO;离子:H 、Cl?、ClO?、OH?
王水浓HNO3∶浓HCl=1∶3溶质的体积比 卤水MgCl2、NaCl及少量MgSO4
硬水溶有较多量Ca2 、Mg2 的水 软水溶有较少量或不溶有Ca2 、Mg2 的水
铁水Fe、C、Mn、Si、S、P等单质的熔融态混合体
苏打水Na2CO3的溶液 生理盐水0.9%的NaCl溶液 硝盐镪水[浓硝盐酸]
水玻璃Na2SiO3水溶液 水泥2CaO·SiO2、3CaO·SiO2、3CaO·Al2O3
2:各种“气”汇集
一 无机的:爆鸣气H2与O2;水煤气或煤气CO与H2;高炉气或高炉煤气CO、CO2、N2
笑气N2O 碳酸气CO2
二有机的:天然气又叫沼气、坑气,主要成分为CH4 电石气CH≡CH,常含有H2S、PH3等
裂化气C1~C4的烷烃、烯烃 裂解气CH2=CH2、CH3CH=CH2、CH2=CHCH=CH2等
焦炉气H2、CH4等 炼厂气C1~C4的气态烃,又叫石油气、油田气。
3:氧化物的分类
一氧化物的分类:成盐氧化物:酸性氧化物、碱性氧化物、两性氧化物、复杂氧化物过氧化物、超氧化物、Fe3O4、Pb3O4等;不成盐氧化物CO、NO
二易混淆概念分辨
酸酐不一定是酸性氧化物:如乙酸酐酐CH3CO2O等;酸性氧化物一定是酸酐。
非金属氧化物不一定是酸性氧化物:如NO、CO、NO2、N2O4、H2O
酸性氧化物不一定是非金属氧化物:如Mn2O7、CrO3
金属氧化物不一定是碱性氧化物:如Al2O3、ZnO两性,Mn2O7、CrO3酸性氧化物
碱性氧化物一定是金属氧化物
※NO2因与碱反应不仅生成盐和水,还有NO,因而不是酸性氧化物。
※Na2O2因与酸反应不仅生成盐和水,还有O2,因而不是碱性氧化物。
4:比较金属性强弱的依据
1、同周期中,从左到右,随核电荷数的增加,非金属性增强; 同主族中,由上到下,随核电荷数的增加,非金属性减弱;
2、依据最高价氧化物的水化物酸性的强弱:酸性愈强,其元素的非金属性也愈强;
3、依据其气态氢化物的稳定性:稳定性愈强,非金属性愈强;
4、与氢气化合的条件;5、与盐溶液之间的置换反应;
6、其他,例:2Cu+S , Cu+Cl2 所以,Cl的非金属性强于S。
6:“10电子”、“18电子”的微粒小结
分子 离子
一核10电子的 Ne N3?、O2?、F?、Na 、Mg2 、Al3
二核10电子的 HF OH- 三核10电子的 H2O NH2-
四核10电子的 NH3 H3O 五核10电子的 CH4 NH4
分子 离子
一核18电子的 Ar K 、Ca2 、Cl?、S2?
二核18电子的 HCl HS- 三核18电子的 H2S、F2
四核18电子的 PH3 五核18电子的 SiH4 、CH3F PH4
六核18电子的 N2H4、CH3OH 注:其它诸如C2H6、N2H5 、N2H62 等亦为18电子的微粒。
7:具有漂白作用的物质
氧化作用:Cl2、O3、Na2O2、浓HNO3;化学变化;不可逆
化合作用:SO2;化学变化;可逆 吸附作用:活性炭;物理变化;可逆
其中能氧化指示剂而使指示剂褪色的主要有Cl2HClO和浓HNO3及Na2O2
8:安全火柴的成分及优点
安全火柴的成分:火柴头:氧化剂K、MnO2、易燃物如硫等、粘合剂
火柴盒侧面:红磷、三硫化二锑、粘合剂 起火原因:摩擦→发热→KClO3分解→使红磷着火→引起火柴头上的易燃物如硫燃烧。 优点:红磷与氧化剂分开,比较安全,无毒性。
9:能升华的物质
I2、干冰固态CO2、升华硫、红磷,萘。蒽和苯甲酸作一般了解。
10:能被活性炭吸附的物质
1、有毒气体NO2、Cl2、NO等——去毒;
2、 色素——漂白; 3、水中有臭味的物质——净化。
11:矽及其化合物十“反常”
1、矽的还原性比碳强,而碳在高温下却能从二氧化矽中还原出矽。SiO2+2C=Si+2CO↑
2、非金属单质一般不与弱氧化性酸反应,而矽不但能与HF反应,而且还有H2生成。Si+4HF=SiF4↑+2H2↑
3、非金属单质与强碱溶液反应一般不生成氢气,而矽却不然。Si+2NaOH+H2O==Na2SiO3+2 H2↑
4、虽然SiO2是矽酸的酸酐,但却不能用SiO2与水反应制备矽酸,只能用可溶性矽酸盐跟酸作用来制备。
5、酸性氧化物一般不与酸反应除氧化还原反应外,而二氧化矽却能与氢氟酸反应。
6、非金属氧化物一般是分子晶体,而二氧化矽却是原子晶体。
7、无机酸一般易溶于水,而矽酸和原矽酸却难溶于水。
8、通常所说的某酸盐为一种酸根的盐,而矽酸盐却是多种矽酸H2SiO3、H4SiO4、H2Si2O5、H6Si2O7等的盐的总称。
9、较强的酸能把较弱的酸从其盐溶液中制取出来,这是复分解反应的一般规律,由此对于反应Na2SiO3+CO2+H2O==Na2CO3+H4SiO4↓的发生是不难理解的,而反应Na2CO3+SiO2=Na2SiO3+CO2↑居然也能进行。
10、矽酸钠的水溶液俗称水玻璃,但它和玻璃的化学成分并不相同。矽酸钠也叫泡花碱,但它是盐而不是碱。钢化玻璃与普通玻璃成分相同,水晶玻璃与玻璃成分不同。
12:碱金属元素具体知识的一般与特殊
1、Na、K均储存在煤油中,防止氧化,但锂单质不能储存在煤油中,因锂单质密度小于煤油,浮于煤油液面,达不到隔绝空气的目的,应储存太平石蜡中。
2、碱金属单质的密度一般随核电荷数的增大而增大,但钾的密度却比钠小。
3、碱金属单质在空气中燃烧大部分生成过氧化物或超氧化物,但锂单质特殊,燃烧后的产物只是普通氧化物。
4、碱金属单质和水反应时,碱金属一般熔点较低,会熔化成小球。但锂的熔点高,不会熔成小球。生成的LiOH溶解度较小,覆盖在锂的表面,使锂和水的反应不易连续进行。
5、碱金属单质和水反应时,碱金属单质一般浮于水面上,但铷、铯等单质和水反应时沉入水底,因铷、铯单质的密度比水大。
6、钠盐的溶解度受温度的变化影响一般都较大,但NaCl的溶解度受温度变化的影响却很小。
7、碱金属的盐一般均易溶于水,但Li2CO3却微溶于水。
8、焰色反应称为“反应”,但却是元素的一种物理性质。
13:Fe3 的颜色变化
1、向FeCl3溶液中加几滴KSCN溶液呈红色;2、FeCl3溶液与NaOH溶液反应,生成红褐色沉淀;
3、向FeCl3溶液溶液中通入H2S气体,生成淡**沉淀;
4、向FeCl3溶液中加入几滴Na2S溶液,生成淡**沉淀;当加入的Na2S溶液过量时,又生成黑色沉淀;
5、向FeCl3溶液中加入过量Fe粉时,溶液变浅绿色;
6、向FeCl3溶液中加入过量Cu粉,溶液变蓝绿色; 7、将FeCl3溶液滴入淀粉KI溶液中,溶液变蓝色;
8、向FeCl3溶液中滴入苯酚溶液,溶液变紫色;
14:“黑色金属”有哪些
化学上把铁、铬、锰三种金属和铁基合金统称为“黑色金属”。
15:Fe2 与Fe3 的鉴别方法
Fe2 与Fe3 的性质不同而又可以相互转化。中学化学中可用以下几种方法加以鉴别。
1.观察法:其溶液呈棕**者是Fe3 ,呈浅绿色者是Fe2 。
2.H2S法:通往H2S气体或加入氢硫酸,有浅**沉淀析出者是Fe3 ,而Fe2 溶液 不反应。2Fe3 +H2S==2Fe2+2H +S↓
3.KSCN法:加入KSCN或其它可溶性硫氰化物溶液,呈血红色者是Fe3 溶液,而Fe2 的溶液无此现象。这是鉴别鉴别Fe3 与Fe2 最常用、最灵敏的方法。Fe3 +SCN?==[FeSCN]2
4.苯酚法:分别加入苯酚溶液,显透明紫色的是Fe3 溶液,无此现象的是Fe2 的溶液。Fe3+6C6H5OH→[FeC6H5O6]3?+6H 了解
5.碱液法:取两种溶液分别通入氨气或碱液,生成红褐色沉淀的是Fe3 溶液,生成白色沉淀并迅速变为灰绿色、最终变成红褐色的是Fe2 溶液。 Fe3 +3NH3·H2O==FeOH3↓+3NH4 ;
Fe3 +3OH?== FeOH3↓ Fe2 +2 NH3·H2O==FeOH2↓+2NH4 ;4 FeOH2+2H2O+O2==4 FeOH3
6.淀粉KI试纸法:能使淀粉KI试纸变蓝的是Fe3 溶液,无变化的是Fe3 溶液。2 Fe3 +2I?==2 Fe2 +I2
7.铜片法:分别加入铜片,铜片溶解且溶液渐渐变为蓝色的是Fe3 溶液,无明显现象的是Fe2 溶液。
2 Fe3 +Cu==2 Fe2 +Cu2
8.KMnO4法:分别加入少量酸性KMnO4溶液,振荡,能使KMnO4溶液紫红色变浅的是Fe2 溶液,颜色不变浅的是Fe3 溶液。5 Fe2 +MnO4?+8H ==5 Fe3 +Mn2 +4H2O
16:金属的冶炼规律
1.活泼金属的冶炼 钠、镁、铝等活泼金属,采用电解其熔融态的卤化物的方法冶炼通直流电。
例如:2NaCl熔融 2Na+Cl2↑ MgCl2熔融 Mg+Cl2↑
2Al2O3熔融 4Al+3O2↑加入Na3AlF6作熔剂
注:这里为何不电解熔融态铝的氯化物而须电解其熔融态的氧化物,读者应掌握AlCl3为共价化合物,熔融态时不电离,而Al2O3为离子化合物,熔融态时可发生电离的道理。
2.中等活泼的金属的冶炼 锌、铁、锡、铅等中等活泼的金属采用还原剂还原它们的氧化物的方法冶炼。
例如:ZnO+C Zn+CO↑ Fe2O3+3CO 2Fe+3CO2 WO3+3H2 W+3H2O
Cr2O3+2Al 2Cr+Al2O3
3.不活泼金属的冶炼 银、铂、金等不活泼金属在自然界可以游离态存在,直接采用物理方法如淘金等冶炼,而铜、汞等不活泼金属可用还原剂还原法或热分解法冶炼。例如:2HgO 2Hg+O2↑
17:“置换反应”有哪些?
1.较活泼金属单质与不活泼金属阳离子间置换 如:Zn+Cu2 ==Zn2 +Cu Cu+2Ag =2Ag
2、活泼非金属单质与不活泼非金属阴离子间置换Cl2 2Br?==2Cl? Br2
I2 S2?==2I? S 2F2+2H2O==4HF+O2
3、 活泼金属与弱氧化性酸中H 置换 2Al+6H ==2Al3?+3H2↑
Zn+2CH3COOH==Zn2 +2CH3COO?+H2↑
4、金属单质与其它化合物间置换 2Mg+CO2 2MgO+C
2Mg+SO2 2MgO+S Mn+FeO MnO+Fe 2Na+2H2O==2Na +2OH?+H2↑
2Na+2C6H5OH熔融→2C6H5ONa+H2↑ 2Na+2C2H5OH→2C2H5ONa+H2↑
10Al+3V2O5 5Al2O3+6V 8Al+3Fe3O4 4Al2O3+9Fe
2FeBr2+3Cl2==2FeCl3+2Br2 2FeI2+ 3Br2==2FeBr3+2I2 Mg+2H2O MgOH2+H2↑
3Fe+4H2O气 Fe3O4+4 H2↑
5、 非金属单质与其它化合物间置换 H2S+X2==S↓+2H +2X?
2H2S+O2 2S+2H2OO2不足 CuO+ C Cu+CO↑ C过量时
2 CuO+C 2Cu+CO2↑ CuO过量时 FeO+ C Fe+CO↑
2FeO+Si SiO2+2Fe↑ 2FeO+C 2Fe+CO2↑ CuO+H2 Cu+H2O
Cu2O+H2 2Cu+H2O SiO2+2C Si+2CO↑ 3Cl2+8NH3==6NH4Cl+N2
3Cl2+2NH3==6HCl+N2
18:条件不同,生成物则不同
1、2P+3Cl2 2PCl3Cl2不足 ;2P+5Cl2 2PCl5Cl2充足
2、2H2S+3O2 2H2O+2SO2O2充足 ;2H2S+O2 2H2O+2SO2不充足
3、4Na+O2 2Na2O 2Na+O2 Na2O2
4、CaOH2+CO2 适量== CaCO3↓+H2O ;CaOH2+2CO2过量==CaHCO32↓
5、2Cl2+2 CaOH2==CaClO2+CaCl2+2H2O 6Cl2+6 CaOH2 CaClO32+5CaCl2+6H2O
6、C+O2 CO2O2充足 ;2C+O2 2CO O2不充足
7、8HNO3稀+3Cu==2NO↑+2CuNO32+4H2O 4HNO3浓+ Cu==2NO2↑+CuNO32+2H2O
8、NaCl固+H2SO4 浓NaHSO4+HCl↑ 2NaCl固+H2SO4 浓Na2SO4+2HCl↑
9、 H3PO4+ NaOH==NaH2PO4+H2O;H3PO4+2NaOH==Na2HPO4+2H2O
H3PO4+3NaOH==Na3PO4+3H2O
10、AlCl3+3NaOH==AlOH3↓+3NaCl ; AlCl3+4NaOH过量==NaAlO2+2H2O
11、NaAlO2+4HCl过量==NaCl+2H2O+AlCl3;NaAlO2+HCl+H2O==NaCl+AlOH3↓
12、Fe+6HNO3热、浓==FeNO33+3NO2↑+3H2O;Fe+HNO3冷、浓→钝化
13、Fe+6HNO3热、浓 FeNO33+3NO2↑+3H2O;Fe+4HNO3热、浓 FeNO32+2NO2↑+2H2O
14、Fe+4HNO3稀=FeNO33+NO↑+2H2O;3Fe+8HNO3稀=3FeNO33+2NO↑+4H2O
15、C2H5OH CH2=CH2↑+H2O C2H5-OH+HO-C2H5 C2H5-O-C2H5+H2O
16.苯与氯气反应
17、C2H5Cl+NaOH C2H5OH+NaCl C2H5Cl+NaOH CH2=CH2↑+NaCl+H2O
18、6FeBr2+3Cl2不足==4FeBr3+2FeCl3 2FeBr2+3Cl2过量==2Br2+2FeCl3
19:滴加顺序不同,现象不同
1、AgNO3与NH3·H2O:AgNO3向NH3·H2O中滴加——开始无白色沉淀,后产生白色沉淀
NH3·H2O向AgNO3中滴加——开始有白色沉淀,后白色沉淀消失2、CaOH2与H3PO4多元弱酸与强碱反应均有此情况:
CaOH2向H3PO4中滴加——开始无白色沉淀,后产生白色沉淀
H3PO4向CaOH2中滴加——开始有白色沉淀,后白色沉淀消失
3、NaOH与AlCl3:NaOH向AlCl3中滴加——开始有白色沉淀,后白色沉淀消失
AlCl3向NaOH中滴加——开始无白色沉淀,后产生白色沉淀4、HCl与NaAlO2:HCl向NaAlO2中滴加——开始有白色沉淀,后白色沉淀消失
NaAlO2向HCl中滴加——开始无白色沉淀,后产生白色沉淀5、Na2CO3与盐酸:Na2CO3向盐酸中滴加——开始有气泡,后不产生气泡
盐酸向Na2CO3中滴加——开始无气泡,后产生气泡20:有关“燃烧”的总结
一“燃烧”的条件:
1.温度达到着火点;2.有助燃剂多指在反应中的氧化剂
二镁在哪些气体中能燃烧?
1.镁在空气氧气中燃烧:2Mg+O2 2MgO 现象:产生白烟,发出耀眼的强光。
2.镁在氯气中燃烧:Mg+Cl2 MgCl2 现象:产生白烟。
3.镁在氮气中燃烧:3Mg+N2 Mg3N2 现象:产生灰**烟。
4.镁在CO2气体中燃烧:2Mg+CO2 2MgO+C现象:产生白烟,瓶壁上有少许淡**物质。
三火焰颜色小结:
H2在空气中燃烧淡蓝色;CH4在空气中燃烧淡蓝色;C2H4在空气中燃烧火焰明亮,黑烟
C2H2在空气中燃烧浓烈的黑烟;H2S在空气中燃烧淡蓝色;C2H5OH在空气中燃烧淡蓝色
S在空气中燃烧淡蓝色;S在纯氧中燃烧蓝紫色;CO在空气中燃烧淡蓝色
H2在Cl2中燃烧苍白色
此外:含钠元素的物质焰色呈**;含钾元素的物质焰色呈紫色透过蓝色钴玻璃片
2023新高考数学考点如下:
1、集合与命题:集合的概念与运算、命题、充要条件。
2、不等式:概念与性质、均值不等式、不等式的证明、不等式的解法、绝对值不等式、不等式的应用。
3、函数:函数的定义、函数解析式与定义域、值域与最值、反函数、三大性质、函数的零点、函数图象、指数与指数函数、对数与对数函数、函数的应用。
4、三角比与三角函数:有关概念、同角关系与诱导公式、和、差、倍、半公式、万能公式、辅助角公式、求值、化简、证明、三角函数的图象与性质、三角函数的应用、反三角函数、最简三角方程。
5、平面向量:有关概念与初等运算、线性运算、三点共线、坐标运算、数量积、三角形“四心”及其应用。
6、数列:数列的有关概念、等差数列、等比数列、通项公式求法、数列求和、数列的应用、数学归纳法、数列的极限与运算、无穷等比数列。
7、直线和圆的方程:方向向量、法向量、直线的方程、两直线的位置关系、线性规划、圆的方程、直线与圆的位置关系。
8、立体几何与空间向量:空间直线、直线与平面、平面与平面、棱柱、棱锥、球与球面距离、几何体的三视图与直观图、几何体的表面积与体积、空间向量。
9、排列、组合:排列、组合应用题、二项式定理及其应用。
10、复数:复数的概念与运算、复数的平方根与立方根计算、实系数一元二次方程。
11、矩阵与行列式初步:二元线性方程组、矩阵的基本运算、二阶行列式、三阶行列式、对角线法则、余子式与代数余子式。
12、算法初步:流程图、算法语句、条件语句、循环语句。